池田屋商社!!环境实验室产品--什么是pH?
池田屋商社!!环境实验室产品--什么是pH?
池田屋商社!!环境实验室产品--什么是pH?

您熟悉pH这个术语吗?pH值在许多领域都有应用,例如皮肤pH值和土壤pH值。多数人会想到的是用石蕊试纸做的pH值实验。本文将为您介绍pH相关的基础知识。
什么是pH?
■ pH是用来表示水溶液性质的单位
pH是用来表示水溶液性质的单位。例如,正如“m”(米)是用于表示长度的单位,pH则是用于表示水溶液的性质的单位。那么,pH表示的具体水溶液的特性是什么呢?
■ 酸性和碱性
柠檬汁的味道很“酸”。肥皂水呈粘稠状,喝到嘴里的人会觉得“苦”。将石蕊试纸浸入相应的溶液中,蓝色试纸在柠檬汁中会变红,红色试纸在肥皂水中会变蓝。变红的试纸证明柠檬汁呈酸性,而变蓝的试纸则证明肥皂水呈碱性。因此,pH是用来表示酸性或碱性水溶液特性的单位。
下图表示了水溶液的酸碱性。中性为pH7,低于pH7的范围为酸性,高于pH7的范围为碱性。

酸性和碱性的概念
■ 氢离子浓度
水溶液的性质(酸性或碱性)与什么有关?
事实上,水溶液的酸碱性是由溶液中的“氢离子浓度”决定的。
水的分子式为H2O,大部分以非常稳定的H2O分子形式存在。
但也及其少量地存在电离出的氢离子(H+)和氢氧根离子(OH-)。
正是这些电离的氢离子和氢氧根离子之间的平衡决定了溶液的酸碱性。
氢离子越多,酸性越强;氢氧根离子越多,碱性越强。
■ 索仑森的定义(酸碱定义)
如果温度不变,氢离子浓度[H+]和氢氧根离子浓度[OH-]的乘积[H+][OH-]始终保持恒定。
水的离子积Kw=[H+][OH-]=10-14(=常量)(25℃时)
Kw也被称为“水解离常数”。
中性时,[H+]=[OH-],可用如下公式表示。
[H+]=[OH-]=√(Kw)=√10-14=10-7
如果可以求出[H+]或[OH-]的值,也可以知道其中一个的值,因此pH是以[H+](氢离子浓度)为标准来确定的。
对于氢离子浓度[H+]非常低(0.000001)的水溶液,小数点后的位数非常多,既麻烦又难以理解。
为此,丹麦化学家索仑森(Sørensen)提出了一个方程式,其定义如下。
pH=-log10[H+].
中性溶液,[H+]=10-7,pH值为7。
■ 重新定义pH
随后的研究表明,pH与氢离子的浓度无关,而是与氢离子的“活性”有关。
因此,1920年对pH的定义作了如下修改。
aH+=f×[H+]
aH+:氢离子活度
f:活动系数
[H+]:氢离子浓度

用玻璃电极检测pH
■ pH计的检测原理
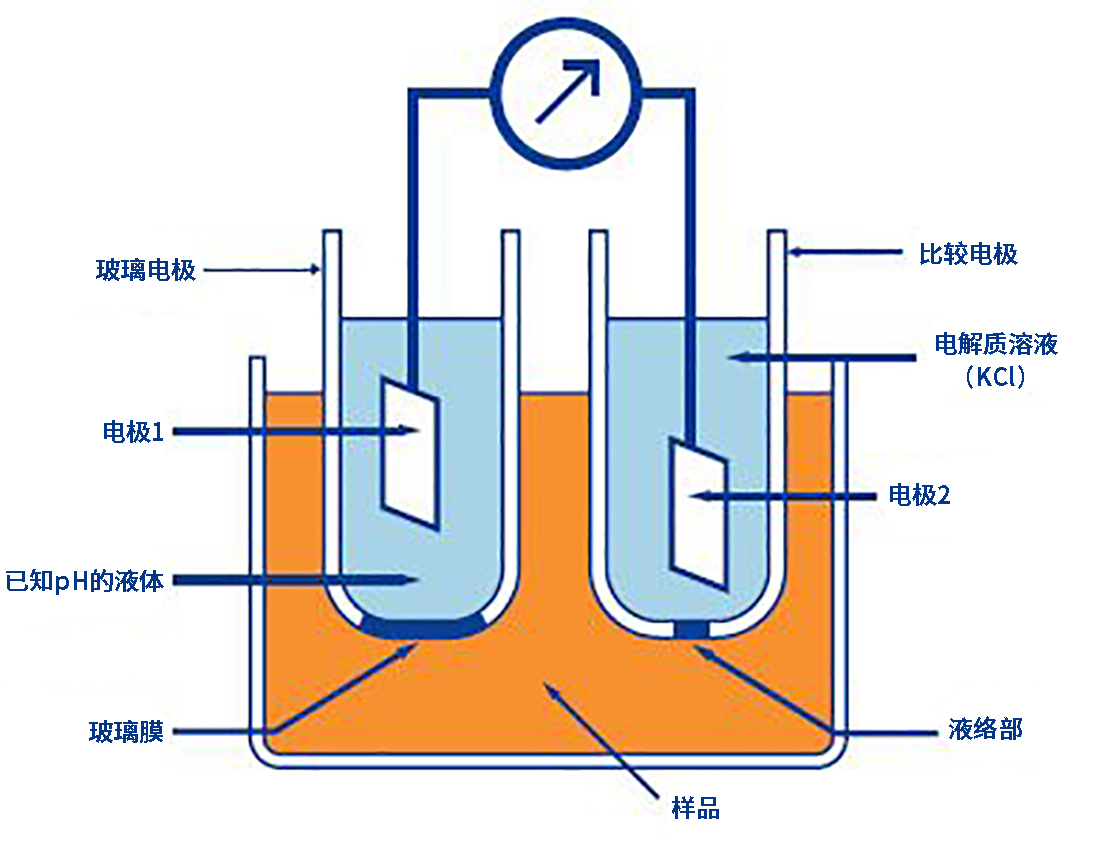
玻璃电极法是一种通过“pH玻璃电极”和“比较电极”的电极之间产生的电位差来测量溶液pH的技术。
薄膜内外存在不同pH值的液体,会在pH玻璃反应膜中产生与pH值地差成正比的“电动势”。
pH玻璃电极的内部液体通常是pH7的液体。测量pH玻璃反应膜的电动势就能得出被测物体的pH值。
还需要另一个电极,即“比较电极”,来测量pH玻璃反应膜的电动势。
■ 玻璃电极
玻璃电极由pH玻璃反应膜、高绝缘支撑管、玻璃电极内部液体、内部电极、引线和玻璃电极端子组成。
最重要的玻璃膜必须满足如下要点。
①必须产生与水溶液pH值对应的电位。
②不能受酸或碱的影响。
③薄膜本身的电阻不能太高。
④当电极浸入与内部溶液相同的溶液中时,液体之间不能出现较大的电位差。
⑤玻璃膜必须具有出色的抗冲击性和耐药性等性能。
一般内部电极常用银或氯化银电极。内部溶液使用的是“氯化钾溶液”,通常调整到pH7左右,并具有额外的pH缓冲能力。
■ 比较电极
比较电极与玻璃电极一起使用,用于测量玻璃电极上产生的电位差。与水溶液的pH无关,比较电极都显示恒定的电位。
比较电极由液体接触网、补充口、内部液体、比较电极支撑管、比较电极内部液体、内部电极和电极引线组成。大多数情况下,内部电极使用银或氯化银电极,内部液体使用氯化钾溶液。
内部液体和样本接触的区域称为“液体接触网”。比较功率要求电极的电位极其稳定,因此“液体接触网”包括针孔型、套筒型、陶瓷型和纤维型。直径为10μm的针孔型具有内部液体泄漏少的优点,但缺点是容易产生液体间电位。带有榫卯表面的套筒型更容易清洁,但缺点是内部液体溢出较多。陶瓷型和纤维型由不同材料制成,虽然内部液体溢出较少,但往往容易吸附样本。这两者结合在一起形成双联结点,可弥补其各自的缺点。
■ 温度补偿电极
根据水溶液温度的不同,玻璃电极上产生的电动势也不同。
“温度补偿”可补偿温度引起的电动势变化。值得注意的是,pH随温度变化,与温度补偿无关。
因此,在测量pH值时,即使使用了带自动温度补偿功能的pH计,如果没有将被测物当时的温度与pH值一起记录下来,测量结果也可能毫无意义。



